Michael Palmer e Sucharit Bhakdi – 2 Ottobre 2022 (traduzione automatica)
Questo documento è stato scritto per rispondere a tre domande posteci da un avvocato che sta sfidando le approvazioni e i mandati del vaccino COVID-19 nel suo paese d’origine. Le risposte possono essere di interesse anche per i lettori di questo sito web.
1. Quali prove sono attualmente disponibili per dimostrare che le particelle del vaccino a mRNA attraversano la barriera emato-encefalica?
Questa domanda non è stata rigorosamente studiata negli esseri umani o negli animali. Segue una panoramica delle limitate prove disponibili.
1.1. Sperimentazione animale con vaccini modello
Sia Pfizer [1] che Moderna [2] hanno condotto studi su animali con vaccini modello che contenevano gli stessi lipidi dei rispettivi vaccini COVID-19, ma mRNA diversi. In entrambi i casi, i componenti di questi vaccini modello sono stati trovati anche nel tessuto cerebrale; Pfizer ha rilevato la componente lipidica e Moderna ha rilevato l’mRNA. In entrambi i casi, le concentrazioni nel tessuto cerebrale erano significativamente inferiori a quelle nel sangue. Tuttavia, come diventerà chiaro di seguito, questi risultati non significano che questi vaccini non danneggeranno il cervello.
1.2. Sul meccanismo di trasporto attraverso la barriera emato-encefalica
In vivo, le nanoparticelle lipidiche del tipo utilizzato nei vaccini Pfizer e Moderna acquisiranno una “corona biomolecolare”, cioè un rivestimento esterno costituito dalle proteine proprie del corpo. Con questo rivestimento, si comportano in modo simile alle particelle naturali di trasporto del grasso del corpo, le lipoproteine. L’assorbimento cellulare delle nanoparticelle lipidiche e il loro trasporto attraverso la barriera emato-encefalica sono mediati in particolare dal rivestimento con le proteine ApoB e ApoE [3,4], che hanno anche lo stesso scopo con le lipoproteine del corpo.
1.3. La proteina spike può influenzare il trasporto attraverso la barriera emato-encefalica?
Mentre le nanoparticelle lipidiche sono importanti, non si dovrebbe trascurare un possibile ruolo dell’mRNA contenuto nel vaccino. È noto che la proteina spike di SARS-CoV-2 può compromettere la funzione della barriera emato-encefalica [5-8]. Molto probabilmente, le particelle del vaccino possono inizialmente essere assorbite da cellule al di fuori del cervello, che poi producono e rilasciano proteine spike nel flusso sanguigno. Questa proteina spike circolante potrebbe quindi agire sulla barriera emato-encefalica e facilitare il passaggio di ulteriori particelle di vaccino nel tessuto cerebrale. Pertanto, sarebbe stato molto importante eseguire questi studi sugli animali con i veri vaccini COVID-19 piuttosto che solo con i vaccini modello. Questo non sarebbe stato particolarmente difficile da un punto di vista tecnico. Con ogni probabilità, i produttori hanno condotto questi studi ma hanno scelto di mantenere i risultati nell’armadietto dei veleni, oppure hanno deliberatamente saltato questi esperimenti per evitare il rischio di ottenere risultati sfavorevoli per loro.
1.4. Barriera emato-encefalica e iniezioni di richiamo
La barriera emato-encefalica è costituita da due strati cellulari: l’endotelio dei piccoli vasi sanguigni forma lo strato interno e le cellule glia del tessuto cerebrale circostante formano lo strato esterno. È noto che la barriera emato-encefalica diventa permeabile durante l’infiammazione. Fino a prova contraria, si deve presumere che ciò si applichi anche all’infiammazione dei vasi sanguigni (vasculite) nel cervello che è stata indotta dai vaccini a mRNA; che questi vaccini causino effettivamente varie forme di vasculite è ora ampiamente documentato in letteratura [9-14]..
In questo contesto, sembra probabile che la prima iniezione di un vaccino a mRNA possa portare all’infiammazione dei vasi cerebrali, che ammorbidirebbe la barriera emato-encefalica. Le particelle di vaccino applicate con la seconda iniezione potrebbero quindi passare senza ostacoli nel tessuto cerebrale. Non è quindi sufficiente studiare il trasporto di vaccini a mRNA attraverso la barriera emato-encefalica solo dopo una singola iniezione, come hanno fatto Pfizer e Moderna nei loro esperimenti sugli animali; invece, il trasporto avrebbe dovuto essere misurato anche dopo iniezioni ripetute.
1.5. Iniezione endovenosa accidentale dei vaccini
I vaccini COVID-19 vengono iniettati per via intramuscolare. Con questa forma di applicazione, si mira ad applicare il farmaco o il vaccino in questione nello spazio extracellulare al di fuori del flusso sanguigno, in modo che rimanga nei tessuti, almeno inizialmente; da lì, può quindi farsi strada nel flusso sanguigno solo lentamente o per niente. Gli studi sugli animali dei produttori sopra citati hanno rilevato che in effetti una grande percentuale di vaccini modello iniettati per via intramuscolare è rimasta nel tessuto muscolare. Le valutazioni del rischio rilasciate dalle varie agenzie di regolamentazione nazionali e internazionali presuppongono tutte che sarà sempre così.
Ogni medico dovrebbe sapere, tuttavia, che anche con una tecnica attenta, cioè con un’aspirazione preventiva [15-17], l’iniezione può avvenire accidentalmente nel flusso sanguigno. Negli studi sugli animali, è stato osservato che la miocardite causata dai vaccini a mRNA è più grave dopo iniezione endovenosa che dopo iniezione intramuscolare [18].. Lo stesso deve essere assunto per essere il caso degli esseri umani e con danni ad altri organi, incluso il cervello.
1.6. Conclusione
In sintesi, i dati disponibili non sono sufficienti per una stima quantitativa affidabile del trasporto di vaccini a mRNA attraverso la barriera emato-encefalica, ma dimostrano comunque qualitativamente che le nanoparticelle lipidiche entrano nel cervello. Le valutazioni ottimistiche delle autorità di regolamentazione su questo tema non tengono conto dei rischi gravi e di importanti fattori confondenti e sono pertanto irrealistiche.
2. Per quanto tempo le nanoparticelle del vaccino possono rimanere nel cervello?
Si dovrebbe prima chiarire che le nanoparticelle in quanto tali probabilmente non durano molto a lungo in nessuna parte del corpo: subito dopo l’assorbimento in una cellula, i lipidi si separeranno dall’RNA. Solo dopo che l’RNA è stato rilasciato in questo modo può iniziare la sintesi della proteina spike all’interno della cellula. Da quel momento in poi, l’arco di tempo dell’attività biologica è molto probabilmente deciso dalla stabilità dell’RNA, sebbene i componenti lipidici possano anche contribuire alla tossicità del vaccino a mRNA.
Come per la questione del trasporto nel cervello, i produttori non hanno fornito dati sufficienti e affidabili sulla persistenza degli mRNA del vaccino nel tessuto cerebrale. Il documento dell’EMA su Moderna contiene di nuovo solo dati sul vaccino modello, non sul vaccino COVID effettivo. Secondo quanto riferito, a tre giorni dall’iniezione, l’mRNA del vaccino modello è rimasto rilevabile solo nel tessuto muscolare, nei linfonodi e nella milza. Pfizer non ha riportato misurazioni dirette dell’RNA, ma solo dati sull’attività della proteina codificata dal vaccino modello (luciferasi). Questa attività è decaduta con un’emivita di circa un giorno [1].. Tuttavia, non sono state effettuate misurazioni sul cervello degli animali.
In entrambi i casi, rimane incerto fino a che punto questi risultati di esperimenti sugli animali si applichino alla durata della vita, all’interno del cervello umano, dell’mRNA che codifica per la proteina spike SARS-CoV-2. Tuttavia, vedremo nella prossima sezione che c’è motivo di credere che l’espressione della proteina spike nel cervello umano, indotta dalla vaccinazione, possa durare molto più a lungo di quanto suggeriscano questi dati animali.
3. Quali danni possono causare le nanoparticelle del vaccino al cervello?
Dovremmo notare fin dall’inizio che, quando si tratta di danni al cervello, la barriera emato-encefalica è meno cruciale di quanto si possa supporre; le ragioni diventeranno chiare nel seguito.
3.1. Corsa
È ormai chiaro che gli eventi avversi causati dai vaccini COVID geneticamente modificati (sia basati su mRNA che su adenovirus) iniziano molto spesso con danni ai vasi sanguigni (vedi Figura 1). La lesione vascolare porta quindi alla formazione di coaguli di sangue; i tessuti e gli organi che dipendono da questi vasi ostruiti per il loro apporto di sangue saranno quindi danneggiati o addirittura periranno. Ictus e infarto sono esempi semplici e praticamente importanti di questo meccanismo patogenetico [19-21]. Un’altra variante è l’emorragia a seguito della rottura dei vasi soggetti a infiammazione indotta dal vaccino [22-24]. Per queste forme di lesione, è sufficiente che le particelle del vaccino vengano prelevate dal sangue circolante nelle cellule delle pareti dei vasi sanguigni. Queste cellule esprimeranno quindi la proteina spike, un antigene estraneo, e quindi incorreranno nell’ira del sistema immunitario, che quindi causa il danno effettivo. Si noti, tuttavia, che in questo scenario le particelle non hanno bisogno di attraversare alcuna barriera anatomica importante; e in particolare, non hanno bisogno di attraversare la barriera emato-encefalica per danneggiare i vasi cerebrali e causare ictus.
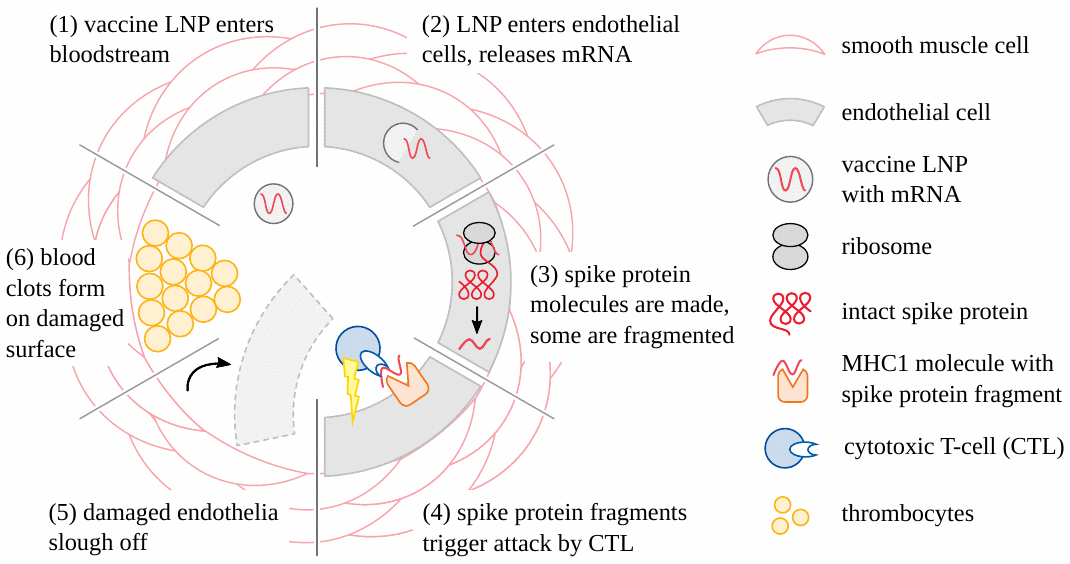
3.2. Infiammazione del cervello e del midollo spinale
Oltre all’ictus, i vaccini a mRNA hanno anche causato molti casi di encefalite e mielite, cioè infiammazione del cervello e del midollo spinale, rispettivamente, e talvolta anche di entrambi contemporaneamente (encefalomielite). I meccanismi patogenetici sono gli stessi con tutte e tre le malattie; per semplicità, useremo solo il termine “encefalite” nel seguito.
3.2.1. Encefalite dovuta a una reazione immunitaria contro la proteina spike
Ci si deve aspettare che questo meccanismo patogenetico operi dai primi principi dell’immunologia. Come potrebbe essere dimostrato in un dato caso di encefalite? I seguenti criteri renderebbero tale diagnosi almeno altamente probabile:
- entro pochi giorni a poche settimane dall’iniezione del vaccino;
- rilevazione di linfociti e altre cellule infiammatorie all’interno del tessuto cerebrale;
- rilevamento della proteina spike nei focolai di infiammazione.
Va notato che i criteri 2 e 3 possono essere soddisfatti solo da esami istopatologici; con il cervello, questi vengono solitamente eseguiti solo dopo l’autopsia, poiché le biopsie su questo organo sono particolarmente precarie.
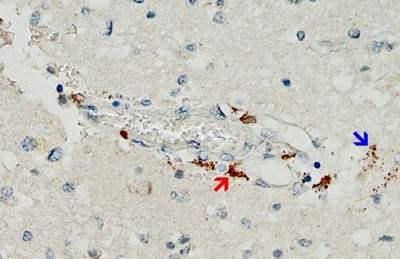
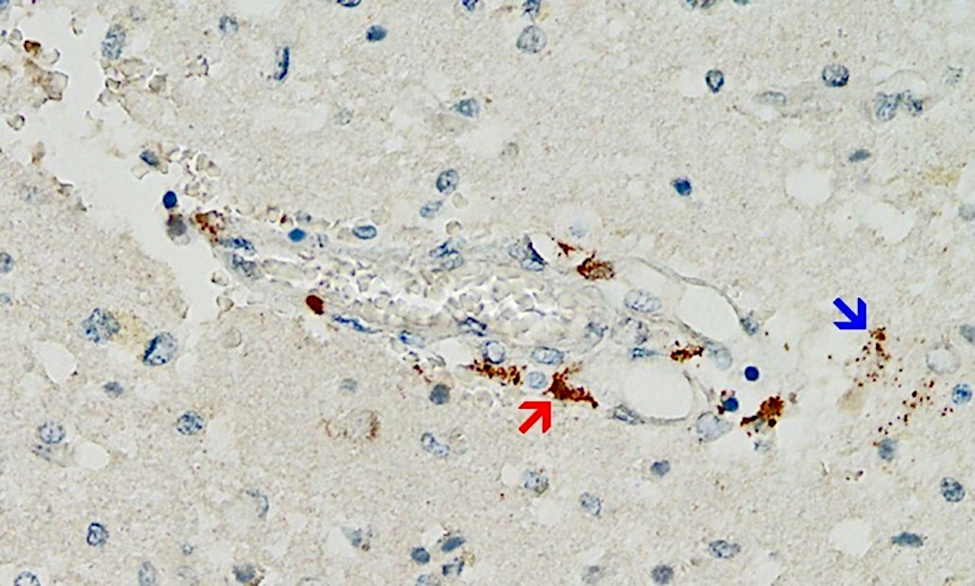
Anche se questo meccanismo è probabilmente di grande importanza, le prove a sostegno finora sono scarse, semplicemente perché i patologi non lo hanno cercato. Tuttavia, è stato appena pubblicato un primo caso clinico che soddisfa tutti i criteri di cui sopra [25] (cfr. figura 2). Questo studio molto meticoloso ha anche escluso che l’espressione rilevata della proteina spike fosse causata dall’infezione con il virus stesso piuttosto che dalla vaccinazione.
Il paziente in questione aveva inizialmente ricevuto una singola iniezione del vaccino adenovirus di AstraZeneca, seguito da due iniezioni del vaccino mRNA di Pfizer. L’ultima iniezione era stata somministrata tre settimane prima del momento della morte. Una marcata espressione della proteina spike è stata rilevata nei capillari cerebrali e anche nelle cellule gliali del tessuto cerebrale, molto probabilmente causata dalla dose più recente di vaccino mRNA. Si deve quindi presumere che la proteina spike sopravviva per almeno diverse settimane dopo l’applicazione dei vaccini a mRNA, e molto probabilmente viene anche continuamente sintetizzata durante questo periodo. Questa scoperta fa eco a studi precedenti su vari tessuti diversi dal cervello e sul sangue [26-29]. L’espressione della proteina spike nelle cellule glia mostra anche inequivocabilmente che uno o entrambi i vaccini possono attraversare la barriera emato-encefalica.
3.2.2. Encefalite autoimmune
In questo meccanismo patogenetico, la connessione con la vaccinazione è indiretta: il vaccino innesca prima un’infiammazione, che potrebbe anche non dover influenzare direttamente il cervello; e nel contesto di questa infiammazione una risposta immunitaria viene attivata non solo contro la proteina spike ma anche contro una o più proteine del corpo o altre biomolecole (autoantigeni). Il sistema immunitario può quindi attaccare questi stessi autoantigeni all’interno di organi bersaglio inizialmente non affetti, incluso il cervello, e innescare l’infiammazione anche lì.
I sintomi clinici, e anche i risultati dell’autopsia quando si utilizzano metodi di routine, saranno probabilmente molto simili a quelli di una reazione immunitaria al picco. Pertanto, come si potrebbe decidere se l’encefalite è innescata dalla proteina spike o da un autoantigene? In una vera encefalite autoimmune, ci si dovrebbe aspettare i seguenti risultati:
- gli autoanticorpi contro gli autoantigeni in questione dovrebbero essere rilevabili nei campioni di sangue;
- la proteina spike non dovrebbe essere rilevabile nelle lesioni infiammatorie;
- la connessione temporale con la vaccinazione potrebbe essere meno stretta, perché gli autoantigeni sono prodotti nel corpo perpetuamente.
Jarius et al. [30] hanno riportato un caso di encefalite autoanticorpo-positiva in un paziente che aveva inizialmente ricevuto due dosi di vaccino a base di adenovirus di AstraZeneca, seguito da una dose di vaccino a mRNA di Pfizer. In questo paziente, una proteina espressa nel cervello – glicoproteina oligodendrocitaria mielinica (MOG) – era l’autoantigene. Questi autori hanno anche fornito una panoramica di altri venti casi precedentemente riportati in letteratura. In tre di questi casi, era stato utilizzato un vaccino a mRNA, mentre i restanti diciassette casi erano associati al vaccino AstraZeneca. Poiché nessuno di questi casi è stato fatale, non è stata ottenuta alcuna evidenza istopatologica positiva o negativa dell’espressione della proteina spike.
Asioli et al. [31] hanno riportato quattro casi di encefalite in cui sono stati rilevati autoanticorpi contro la proteina LGI1. Tre di questi casi, tutti provenienti dalla stessa città (Bologna), si sono verificati dopo l’iniezione di vaccini a mRNA. Un caso particolarmente eclatante è stato riportato da Poli et al. [32]. Questo paziente ha sviluppato contemporaneamente tre diverse malattie autoimmuni: encefalite demielinizzante, miastenia e tiroidite. Tuttavia, non sono stati rilevati autoanticorpi specifici che potrebbero spiegare l’encefalite in questo caso.
3.2.3. Encefalite autoimmune negativa agli anticorpi
In diversi casi clinici di encefalite dopo iniezione di vaccini a mRNA, è stata fatta la diagnosi di “encefalite autoimmune negativa agli anticorpi” ( [33-35]. È certamente ragionevole supporre che in molti di questi casi un autoantigene non identificato possa essere stato causale. D’altra parte, senza istopatologia, sarà spesso impossibile decidere se un dato caso di encefalite è stato causato da una reazione immunitaria contro un autoantigene sconosciuto o contro la proteina spike.
3.3. Conclusione
Numerosi casi di encefalite, mielite ed encefalomielite sono stati riportati dopo l’uso di vaccini a mRNA e anche di vaccini a base di adenovirus. Sia le reazioni autoimmuni che una reazione immunitaria contro la proteina spike si sono dimostrate causali in casi specifici. La rispettiva proporzione di ciascuna forma sul numero totale di tutti i casi clinici di encefalite non può essere determinata sulla base delle evidenze attualmente disponibili.
4. Riepilogo
Ci sono numerosi casi clinici di disturbi del sistema nervoso centrale a seguito dell’uso di vaccini a mRNA contro COVID-19. Questi disturbi includono ictus, emorragia cerebrale ed encefalite. Non è necessario che i vaccini attraversino la barriera emato-encefalica per danneggiare il cervello; tuttavia, ciò deve essere considerato possibile, specialmente dopo iniezioni ripetute o iniezioni endovenose accidentali, ed è probabile che aggravi il decorso clinico dell’encefalite.
Referenze
- (2020) VACCINO SARS-CoV-2 mRNA (BNT162, PF-07302048) 2.6.4 Dichiarazione riassuntiva dello studio di farmacocinetica [traduzione inglese].
- (2021) Rapporto di valutazione EMA: COVID-19 Vaccine Moderna.
- (2002) Trasporto mediato da apolipoproteine di farmaci legati a nanoparticelle attraverso la barriera emato-encefalica. Giornale di targeting di farmaci 10: 317-25
- (2020) La corona biomolecolare delle nanoparticelle lipidiche per la terapia genica. Bioconiugg. Chimica 31:2046-2059
- (2020) La proteina spike SARS-CoV-2 altera la funzione di barriera in modelli in vitro statici e microfluidici 3D della barriera emato-encefalica umana. Neurobiol. Dis. 146:105131
- (2021) La proteina Spike SARS-CoV-2 interrompe l’integrità della barriera emato-encefalica tramite l’attivazione di RhoA. J. Neuroimmune Pharmacol. 16:722-728
- (2022) Penetrazione della proteina spike SARS-CoV-2 attraverso la barriera emato-encefalica, come rivelato da una combinazione di un sistema di modelli di coltura cellulare umana e biosensing ottico. Biomedicina 10 (prestampa)
- (2021) La proteina S1 di SARS-CoV-2 attraversa la barriera emato-encefalica nei topi. Neuroscie 24:368-378
- (2022) Vasculite necrotizzante de novo e recidivante dopo la vaccinazione COVID-19. Clin. Rene J. 15:560-563
- (2022) Vasculite leucocitoclastica (vasculite cutanea dei piccoli vasi) dopo la vaccinazione COVID-19. J. Autoimmun. 127:102783
- (2022) Arterite a cellule giganti che si presenta con tosse cronica e mal di testa dopo la vaccinazione BNT162b2 mRNA COVID-19. QJM (prestampa)
- (2022) Un caso clinico di vasculite associata a MPO-ANCA a seguito di vaccinazione di richiamo eterologa mRNA1273 COVID-19. J. Korean Med. Sci. 37:e204
- (2022) Vasculite IgA di nuova insorgenza dimostrata da biopsia renale dopo aver ricevuto il vaccino mRNA-1273 COVID-19: caso clinico. CEN Case Rep. (prestampa)
- (2022) Vasculite sistemica a seguito di vaccinazione contro l’mRNA SARS-CoV-2 dimostrata su FDG PET/CT. Clin. Nucl. Med. 47:e403-e405
- (2022) Aspirare o non aspirare? Considerazioni per i vaccini COVID-19. Pharmacol. Rep. (prestampa)
- (1999) Tecniche di iniezione sicure. Nurs. Alzarsi. 13:47-53; quiz 54
- (1988) Lesioni intravascolari da penicillina intramuscolare. Clin. Pediatra. Phila 27:85-90
- (2021) L’iniezione endovenosa del vaccino mRNA COVID-19 può indurre miopericardite acuta in modelli murini. Clin. Infettare. Dis. (prestampa)
- (2022) Infarto miocardico, ictus ed embolia polmonare dopo il vaccino BNT162b2 mRNA COVID-19 nelle persone di età pari o superiore a 75 anni. JAMA 327:80-82
- (2022) Infarto acuto del colon gastrico e non mesenterico a seguito della vaccinazione mRNA COVID-19. Asia J. Surg. 45:1469-1470
- (2022) Arterite renale isolata con infarto identificata dopo vaccino SARS-CoV-2. Circ. J. 86:1144
- (2022) Emorragia intracranica dovuta a potenziale rottura di una malformazione artero-venosa dopo la vaccinazione mRNA BNT162b2 COVID-19 in una giovane donna coreana: caso clinico. Vaccini 10 (prestampa)
- (2022) Emorragia intracerebrale dovuta a vasculite a seguito della vaccinazione COVID-19: un caso clinico. Acta Neurochir. Vienna 164:543-547
- (2022) Rottura dell’arteria vertebrale che disseziona l’aneurisma dopo la vaccinazione anti-COVID-19 dell’mRNA: un rapporto di due casi. NMC Caso Rep. J. 9:95-100
- (2022) Un caso clinico: encefalite necrotizzante multifocale e miocardite dopo la vaccinazione mRNA BNT162b2 contro Covid-19. Vaccini 10:2022060308
- (2021) Cutting Edge: gli esosomi circolanti con proteina SPIKE COVID sono indotti dalla vaccinazione BNT162b2 (Pfizer-BioNTech) prima dello sviluppo di anticorpi: un nuovo meccanismo per l’attivazione immunitaria da parte dei vaccini a mRNA. J. Immunol. 207:2405-2410
- (2022) Caratterizzazione clinica e molecolare di un raro caso di miosite associata al vaccino BNT162b2 mRNA COVID-19. Vaccini 10 (prestampa)
- (2022) Imprinting immunitario, ampiezza del riconoscimento delle varianti e risposta del centro germinale nell’infezione e nella vaccinazione umana da SARS-CoV-2. Cella (prestampa)
- (2022) L’infezione persistente da virus della varicella zoster a seguito della vaccinazione contro l’mRNA COVID-19 è stata associata alla presenza di proteina spike codificata nella lesione. J. Cutan. Immunol. Allergia (prestampa)
- (2022) Encefalomielite MOG dopo vaccinazione contro la sindrome respiratoria acuta grave coronavirus di tipo 2 (SARS-CoV-2): case report e revisione completa della letteratura. J. Neurol. (prestampa)
- (2022) Encefalite anti-LGI1 a seguito della vaccinazione COVID-19: una serie di casi. J. Neurol. (prestampa)
- (2022) Sindromi autoimmuni multiple tra cui encefalomielite acuta disseminata, miastenia grave e tiroidite a seguito della vaccinazione COVID-19 a base di acido ribonucleico messaggero: un caso clinico. Neurol. 13:913515
- (2021) Encefalomielite acuta disseminata dopo vaccinazione SARS-CoV-2. Neurochirurgo 208:106839
- (2022) Epilettico refrattario di nuova insorgenza a causa di encefalite autoimmune dopo la vaccinazione contro SARS-CoV-2: primo caso clinico. Neurol. 13:946644
- (2022) Encefalite acuta dopo vaccinazione COVID-19: un caso clinico e una revisione della letteratura. Colmo Vaccin. Immunother. p. 2082206